| MENULIS PERSAMAAN IONIK UNTUK REAKSI REDOKS Halaman ini menjelaskan cara bekerja reaksi setengah-elektron untuk proses oksidasi dan reduksi, dan kemudian bagaimana menggabungkannya untuk memberikan persamaan ion keseluruhan untuk reaksi redoks. Ini adalah keterampilan penting dalam kimia anorganik. Jangan khawatir jika Anda butuh waktu lama di tahap awal. Ini adalah proses yang cukup lambat bahkan dengan pengalaman. Luangkan waktu Anda dan berlatih sebanyak mungkin. Elektron-setengah-persamaanApa itu persamaan setengah elektron? Ketika magnesium mengurangi tembaga panas (II) oksida menjadi tembaga, persamaan ion untuk reaksi adalah: | |
Anda dapat membagi persamaan ionik menjadi dua bagian, dan melihatnya dari sudut pandang magnesium dan ion tembaga (II) secara terpisah. Ini menunjukkan dengan jelas bahwa magnesium telah kehilangan dua elektron, dan ion tembaga (II) telah mendapatkannya.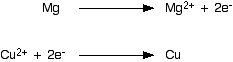 Kedua persamaan ini digambarkan sebagai "persamaan setengah elektron" atau "persamaan setengah" atau "persamaan setengah ion" atau "setengah reaksi" - banyak variasi semuanya memiliki makna yang persis sama! Setiap reaksi redoks terdiri dari dua reaksi setengah: di salah satu dari mereka elektron hilang (proses oksidasi) dan yang lain elektron yang diperoleh (proses reduksi). | |
|
Mengerjakan persamaan setengah elektron dan menggunakannya untuk membangun persamaan ionik Pada contoh di atas, kita mendapatkan persamaan setengah-elektron dengan memulai dari persamaan ionik dan mengekstraksi setengah reaksi individu dari persamaan tersebut. Itu melakukan semuanya sepenuhnya dengan cara yang salah! Pada kenyataannya, Anda hampir selalu mulai dari persamaan setengah elektron dan menggunakannya untuk membangun persamaan ionik. Contoh 1: Reaksi antara ion klorin dan besi (II) Gas klorin mengoksidasi ion besi (II) menjadi ion besi (III). Dalam prosesnya, klor direduksi menjadi ion klorida. Anda harus mengetahui hal ini, atau diberi tahu oleh penguji. Dalam membangun persamaan, ada banyak hal yang bisa Anda kerjakan saat Anda melanjutkan, tetapi Anda harus memiliki tempat untuk memulai! Anda mulai dengan menuliskan apa yang Anda ketahui untuk setiap setengah reaksi. Dalam kasus klorin, Anda tahu bahwa klorin (sebagai molekul) berubah menjadi ion klorida: Hal pertama yang harus dilakukan adalah menyeimbangkan atom yang Anda miliki sejauh mungkin: SELALU memeriksa apakah Anda memiliki atom yang ada seimbang sebelum Anda melakukan hal lain. Jika Anda lupa melakukan ini, semua yang Anda lakukan sesudahnya adalah buang-buang waktu! Sekarang Anda harus menambahkan hal-hal ke setengah-persamaan untuk membuatnya seimbang sepenuhnya. Yang diizinkan untuk Anda tambahkan adalah:
Itu mudah dilakukan dengan menambahkan dua elektron ke sisi kiri. Versi akhir dari setengah reaksi adalah: Sekarang Anda ulangi untuk ion besi (II). Anda tahu (atau diberi tahu) bahwa mereka dioksidasi menjadi ion besi (III). Tulis ini: Atom-atom seimbang, tetapi tuduhannya tidak. Ada 3 muatan positif di sisi kanan, tetapi hanya 2 di sebelah kiri. Anda perlu mengurangi jumlah muatan positif di sisi kanan. Itu mudah dilakukan dengan menambahkan elektron ke sisi itu: Menggabungkan setengah reaksi untuk membuat persamaan ionik untuk reaksi Apa yang kita punya saat ini adalah ini: 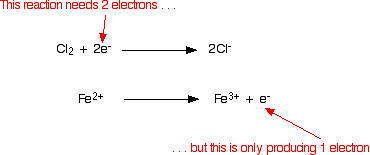 Jelas bahwa reaksi besi harus terjadi dua kali untuk setiap molekul klor yang bereaksi. Izinkan untuk itu, dan kemudian tambahkan dua persamaan setengah. 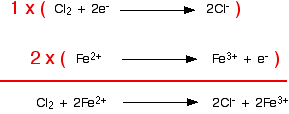 Tapi jangan berhenti di situ !! Periksa apakah semuanya seimbang - atom dan muatan. Sangat mudah untuk membuat kesalahan kecil, terutama jika Anda mencoba mengalikan dan menambahkan persamaan yang lebih rumit. Anda akan melihat bahwa saya belum repot-repot memasukkan elektron dalam versi tambahan. Jika Anda memikirkannya, pasti ada angka yang sama di setiap sisi dari persamaan final, sehingga mereka akan dibatalkan. Jika Anda tidak puas dengan hal ini, tuliskan dan buang lagi setelahnya! Contoh 2: Reaksi antara ion hidrogen peroksida dan ion manganat (VII) Contoh pertama adalah sedikit kimia yang mungkin Anda temui. Teknik ini bekerja dengan baik untuk kimia yang lebih rumit (dan mungkin asing). Ion manganat (VII), MnO 4 - , mengoksidasi hidrogen peroksida, H 2 O 2 , menjadi gas oksigen. Reaksi dilakukan dengan larutan kalium manganat (VII) dan larutan hidrogen peroksida diasamkan dengan asam sulfat encer. Selama reaksi, ion manganat (VII) direduksi menjadi ion mangan (II). Mari kita mulai dengan setengah-persamaan hidrogen peroksida. Yang kami tahu adalah: Oksigen sudah seimbang. Bagaimana dengan hidrogen? Yang diizinkan untuk Anda tambahkan ke persamaan ini adalah air, ion hidrogen, dan elektron. Jika Anda menambahkan air untuk memasok atom hidrogen tambahan yang dibutuhkan di sisi kanan, Anda akan mengacaukan oksigen lagi - itu jelas salah! Tambahkan dua ion hidrogen ke sisi kanan. Sekarang yang perlu Anda lakukan adalah menyeimbangkan biaya. Anda harus menambahkan 2 elektron ke sisi kanan untuk membuat muatan keseluruhan di kedua sisi nol. Sekarang untuk setengah-persamaan manganate (VII): Anda tahu (atau diberi tahu) bahwa ion manganat (VII) berubah menjadi ion mangan (II). Tulis itu. Saldo mangan, tetapi Anda membutuhkan empat oksigen di sisi kanan. Ini hanya dapat berasal dari air - itulah satu-satunya hal yang mengandung oksigen yang diizinkan untuk Anda tulis dalam salah satu persamaan ini dalam kondisi asam. Dengan melakukan ini, kami telah memperkenalkan beberapa hidrogen. Untuk menyeimbangkan ini, Anda akan membutuhkan 8 ion hidrogen di sisi kiri. Sekarang semua atom seimbang, yang perlu Anda lakukan adalah menyeimbangkan muatannya. Saat ini ada 7+ biaya bersih di sisi kiri (1- dan 8+), tetapi hanya 2+ di sebelah kanan. Tambahkan 5 elektron ke sisi kiri untuk mengurangi 7+ menjadi 2+. Ini adalah semacam setengah persamaan yang harus Anda selesaikan. Urutannya biasanya:
Dua persamaan setengah yang kami hasilkan adalah: 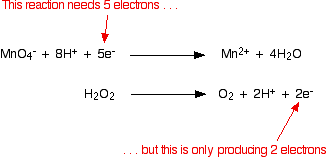 Anda harus mengalikan persamaan sehingga jumlah elektron yang sama terlibat dalam keduanya. Dalam hal ini, semuanya akan bekerja dengan baik jika Anda mentransfer 10 elektron. 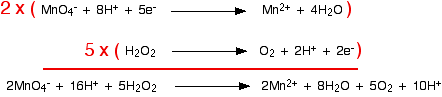  Anda akan sering menemukan bahwa ion hidrogen atau molekul air muncul di kedua sisi persamaan ionik dalam kasus rumit yang terbentuk dengan cara ini. Selalu periksa, dan kemudian sederhanakan jika memungkinkan. Contoh 3: Oksidasi etanol oleh kalium dikromat diasamkan (VI) Teknik ini dapat digunakan dengan baik dalam contoh-contoh yang melibatkan bahan kimia organik. Larutan kalium dikromat (VI) yang diasamkan dengan asam sulfat encer digunakan untuk mengoksidasi etanol, CH 3CH 2 OH, menjadi asam etanoat, CH 3 COOH. Zat pengoksidasi adalah ion dikromat (VI), Cr 2 O 7 2- . Ini direduksi menjadi ion kromium (III), Cr 3+ . Kami akan melakukan setengah-persamaan etanol menjadi asam etanoat terlebih dahulu. Dengan menggunakan tahapan yang sama seperti sebelumnya, mulailah dengan menuliskan apa yang Anda ketahui: Seimbangkan oksigen dengan menambahkan molekul air ke sisi kiri: Tambahkan ion hidrogen ke sisi kanan untuk menyeimbangkan hidrogen: Dan akhirnya menyeimbangkan muatan dengan menambahkan 4 elektron ke sisi kanan untuk memberikan muatan nol keseluruhan di setiap sisi: Setengah-dichromate (VI) berisi jebakan yang jatuh ke tangan banyak orang! Mulailah dengan menuliskan apa yang Anda ketahui: Apa yang sering dilupakan orang pada tahap ini adalah menyeimbangkan kromium. Jika Anda tidak melakukan itu, Anda pasti akan mendapatkan jawaban yang salah di akhir proses! Ketika Anda menyeimbangkan muatan, Anda harus menulis dalam jumlah elektron yang salah - yang berarti bahwa faktor pengali Anda akan salah ketika Anda menambahkan setengah persamaan. . . Buang-buang waktu! Sekarang menyeimbangkan oksigen dengan menambahkan molekul air. . . . . . dan hidrogen dengan menambahkan ion hidrogen: Sekarang semua yang perlu diseimbangkan adalah biaya. Tambahkan 6 elektron ke sisi kiri untuk memberikan jaring 6+ di setiap sisi. Menggabungkan setengah reaksi untuk membuat persamaan ionik untuk reaksi Apa yang kita miliki sejauh ini adalah: 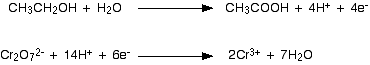 Apa faktor pengali untuk persamaan kali ini? Cara paling sederhana untuk menyelesaikannya adalah dengan menemukan jumlah elektron terkecil yang akan dibagi menjadi 4 dan 6 - dalam hal ini, 12. Itu berarti Anda dapat mengalikan satu persamaan dengan 3 dan yang lainnya dengan 2. | |
Perkalian dan penambahan terlihat seperti ini: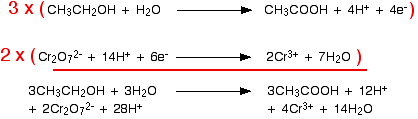 Sekarang Anda akan menemukan bahwa ada molekul air dan ion hidrogen yang terjadi di kedua sisi persamaan ionik. Anda dapat menyederhanakan ini untuk memberikan persamaan terakhir: | |
| Reaksi dilakukan dalam kondisi basa Mengerjakan setengah persamaan untuk reaksi dalam larutan alkali jelas lebih rumit daripada yang di atas, Oleh Karena Itu, Saya Akan mempostingnya Terpisah. Silah kan cek link : Sumber : © Jim Clark 2002 | |
Sunday, June 2, 2019
TERNYATA BEGINI CARA MENYETARAKAN REAKSI REDOKS!!! MUDAH DIPAHAMI !!! | MENULIS PERSAMAAN IONIK UNTUK REAKSI REDOKS
Subscribe to:
Post Comments (Atom)
No comments:
Write komentar