| BILANGAN OKSIDASI (ANGKA OKSIDASI)
Menjelaskan status oksidasi (bilangan oksidasi) Keadaan oksidasi menyederhanakan seluruh proses kerja apa yang sedang teroksidasi dan apa yang sedang dikurangi dalam reaksi redoks. Namun, untuk tujuan pengantar ini, akan sangat membantu jika Anda tahu tentang:
| ||||||||||||||||||||||
| Kita akan melihat beberapa contoh dari kimia vanadium. Jika Anda tidak tahu apa-apa tentang vanadium, tidak masalah sedikit pun. Vanadium membentuk sejumlah ion yang berbeda - misalnya, V 2+ dan V 3+ . Jika Anda berpikir tentang bagaimana ini dapat dihasilkan dari logam vanadium, ion 2+ akan dibentuk dengan mengoksidasi logam dengan menghilangkan dua elektron: Vanadium sekarang dikatakan dalam keadaan oksidasi +2. Penghapusan elektron lain menghasilkan ion V 3+ : Vanadium sekarang memiliki tingkat oksidasi +3. Penghapusan elektron lain memberikan ion yang tampak lebih tidak biasa, VO 2+ . Vanadium sekarang dalam keadaan oksidasi +4. Perhatikan bahwa keadaan oksidasi tidak hanya menghitung muatan pada ion (itu berlaku untuk dua kasus pertama tetapi tidak untuk yang satu ini). Keadaan oksidasi positif menghitung jumlah total elektron yang harus dihilangkan - mulai dari elemen. Dimungkinkan juga untuk menghapus elektron kelima untuk memberikan ion lain (mudah bingung dengan yang sebelumnya!). Keadaan oksidasi vanadium sekarang +5. Setiap kali Anda mengoksidasi vanadium dengan mengeluarkan elektron lain darinya, tingkat oksidasinya meningkat sebesar 1. Jelas sekali, jika Anda mulai menambahkan elektron lagi, tingkat oksidasi akan turun. Anda akhirnya bisa kembali ke elemen vanadium yang akan memiliki tingkat oksidasi nol. Bagaimana jika Anda terus menambahkan elektron ke elemen? Anda sebenarnya tidak bisa melakukannya dengan vanadium, tetapi Anda bisa dengan elemen seperti belerang. Sulfur memiliki tingkat oksidasi -2. Ringkasan Keadaan oksidasi menunjukkan jumlah total elektron yang telah dihilangkan dari suatu unsur (keadaan oksidasi positif) atau ditambahkan ke suatu unsur (keadaan oksidasi negatif) untuk mencapai keadaan saat ini.
Mengatasi keadaan oksidasi Anda tidak menghitung status oksidasi dengan menghitung jumlah elektron yang ditransfer. Itu akan memakan waktu terlalu lama. Alih-alih, Anda mempelajari beberapa aturan sederhana, dan melakukan sejumlah penjumlahan yang sangat sederhana!
| ||||||||||||||||||||||
Catatan: Telah ditunjukkan kepada saya bahwa ada beberapa senyawa yang tidak jelas dari unsur natrium menjadi cesium di mana logam membentuk ion negatif - misalnya, Na - . Itu akan memberikan keadaan oksidasi -1. Anda dapat mengabaikan ini jika Anda melakukan kimia pada level A atau yang setara. Generalisasi bahwa logam Golongan 1 selalu memiliki keadaan oksidasi +1 berlaku baik untuk semua senyawa yang mungkin Anda temui.Jika Anda tertarik pada senyawa aneh ini, lakukan pencarian di internet untuk alkalida . | ||||||||||||||||||||||
| Alasan pengecualian Hidrogen dalam hidrida logam Hidrida logam termasuk senyawa seperti natrium hidrida, NaH. Dalam hal ini, hidrogen hadir sebagai ion hidrida, H - . Keadaan oksidasi ion sederhana seperti hidrida sama dengan muatan pada ion - dalam hal ini, -1. Atau, Anda dapat memikirkannya bahwa jumlah keadaan oksidasi dalam senyawa netral adalah nol. Karena logam Golongan 1 selalu memiliki keadaan oksidasi +1 dalam senyawanya, maka hidrogen harus memiliki keadaan oksidasi -1 (+1 -1 = 0). Oksigen dalam peroksida Peroksida termasuk hidrogen peroksida, H 2O 2 . Ini adalah senyawa yang netral secara listrik dan karenanya jumlah keadaan oksidasi hidrogen dan oksigen harus nol. Karena setiap hidrogen memiliki tingkat oksidasi +1, setiap oksigen harus memiliki keadaan oksidasi -1 untuk menyeimbangkannya. Oksigen dalam F 2 O Masalahnya di sini adalah oksigen bukanlah unsur yang paling elektronegatif. Fluor lebih elektronegatif dan memiliki tingkat oksidasi -1. Dalam hal ini, oksigen memiliki tingkat oksidasi +2. Klorin dalam senyawa dengan fluor atau oksigen Ada begitu banyak keadaan oksidasi yang berbeda yang dimiliki klorin dalam hal ini, sehingga lebih aman untuk hanya mengingat bahwa klorin tidak memiliki keadaan oksidasi -1 di dalamnya, dan bekerja pada keadaan oksidasi yang sebenarnya ketika Anda membutuhkannya. Anda akan menemukan contoh di bawah ini. Peringatan! Jangan terlalu macet dalam pengecualian ini. Dalam sebagian besar kasus yang akan Anda temui, mereka tidak berlaku! Contoh dari keadaan oksidasi Bagaimana keadaan oksidasi kromium dalam Cr 2+ ? Itu mudah! Untuk ion sederhana seperti ini, keadaan oksidasi adalah muatan pada ion - dengan kata lain: +2 (Jangan lupa tanda +.) Bagaimana keadaan oksidasi kromium dalam CrCl 3 ? Ini adalah senyawa netral sehingga jumlah keadaan oksidasi adalah nol. Klorin memiliki tingkat oksidasi -1. Jika keadaan oksidasi kromium adalah n :
Ini adalah ion dan jumlah keadaan oksidasi sama dengan muatan pada ion. Ada jalan pintas untuk menentukan keadaan oksidasi dalam ion kompleks seperti ini di mana atom logam dikelilingi oleh molekul netral elektrik seperti air atau amonia. Jumlah keadaan oksidasi dalam molekul netral yang terpasang harus nol. Itu berarti bahwa Anda dapat mengabaikannya ketika Anda melakukan penjumlahan. Ini pada dasarnya akan sama dengan ion kromium yang tidak terikat, Cr 3+ . Keadaan oksidasi adalah +3. Bagaimana keadaan oksidasi kromium dalam ion dikromat, Cr 2 O 7 2- ? Keadaan oksidasi oksigen adalah -2, dan jumlah keadaan oksidasi sama dengan muatan pada ion. Jangan lupa bahwa ada 2 atom kromium.
| ||||||||||||||||||||||
| Bagaimana keadaan oksidasi tembaga dalam CuSO 4 ? Sayangnya, tidak selalu memungkinkan untuk mengetahui keadaan oksidasi dengan menggunakan aturan-aturan di atas. Masalah dalam hal ini adalah bahwa senyawa tersebut mengandung dua elemen (tembaga dan belerang) yang keadaan oksidasi keduanya dapat berubah. Satu-satunya cara untuk mengatasinya adalah dengan mengetahui beberapa kimia sederhana! Ada dua cara Anda mungkin mendekatinya. (Mungkin ada yang lain juga, tapi aku tidak bisa memikirkan mereka saat ini!)
Dalam penamaan senyawa Anda akan menemukan nama-nama seperti besi (II) sulfat dan besi (III) klorida. (II) dan (III) adalah keadaan oksidasi besi dalam dua senyawa: +2 dan +3 masing-masing. Itu memberitahu Anda bahwa mereka mengandung ion Fe 2+ dan Fe 3+ . Ini juga dapat diperluas ke ion negatif. Besi (II) sulfat adalah FeSO 4 . Ada juga senyawa FeSO 3 dengan nama lama besi (II) sulfit. Nama-nama modern mencerminkan keadaan oksidasi sulfur dalam dua senyawa. Ion sulfat adalah SO 4 2- . Keadaan oksidasi sulfur adalah +6 (berhasil!). Ion ini lebih tepat disebut ion sulfat (VI). Ion sulfit adalah SO 3 2- . Keadaan oksidasi sulfur adalah +4 (berhasil juga!). Ion ini lebih tepat disebut ion sulfat (IV). Akhir makanhanya menunjukkan bahwa belerang berada dalam ion negatif. Jadi FeSO 4 secara tepat disebut besi (II) sulfat (VI), dan FeSO 3 adalah besi (II) sulfat (IV). Bahkan, karena mudahnya kebingungan antara nama-nama ini, nama-nama lama sulfat dan sulfit biasanya masih digunakan dalam kursus kimia pengantar. | ||||||||||||||||||||||
Catatan: Bahkan ini bukan nama lengkap! Oksigen dalam ion negatif juga harus diidentifikasi. FeSO 4 secara tepat disebut besi (II) tetraoxosulphate (VI). Semuanya menjadi sedikit tidak terkendali untuk penggunaan sehari-hari untuk ion umum. | ||||||||||||||||||||||
|
Menggunakan status oksidasi untuk mengidentifikasi apa yang telah teroksidasi dan apa yang telah dikurangi Ini dengan mudah menggunakan kondisi oksidasi yang paling umum. Ingat:
Contoh 1: Ini adalah reaksi antara magnesium dan asam klorida atau gas hidrogen klorida: Apakah keadaan oksidasi dari sesuatu berubah? Ya, mereka punya - Anda memiliki dua elemen yang berada dalam senyawa di satu sisi persamaan dan sebagai elemen yang tidak terikat di sisi lain. Periksa semua status oksidasi untuk memastikan :. 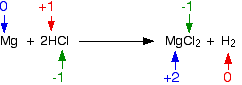 Keadaan oksidasi magnesium telah meningkat - telah teroksidasi. Keadaan oksidasi hidrogen telah turun - telah berkurang. Klorin berada dalam kondisi oksidasi yang sama di kedua sisi persamaan - klorin belum teroksidasi atau dikurangi. Contoh 2: Reaksi antara natrium hidroksida dan asam klorida adalah: Memeriksa semua status oksidasi: 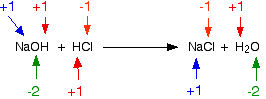 Tidak ada yang berubah. Ini bukan reaksi redoks. Contoh 3: Ini yang licik! Reaksi antara klorin dan larutan natrium hidroksida encer dingin adalah: Jelas bahwa klorin telah mengubah keadaan oksidasi karena telah berakhir dalam senyawa yang dimulai dari unsur aslinya. Memeriksa semua status oksidasi menunjukkan: 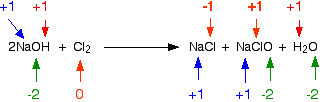 Klorin adalah satu - satunya hal yang mengubah keadaan oksidasi. Apakah sudah dioksidasi atau dikurangi? Iya nih! Kedua! Satu atom telah berkurang karena tingkat oksidasi telah turun. Yang lainnya telah dioksidasi. Ini adalah contoh yang baik dari reaksi disproporsi . Reaksi disproporsionasi adalah reaksi dimana zat tunggal teroksidasi dan tereduksi. Menggunakan status oksidasi untuk mengidentifikasi zat pengoksidasi dan pereduksi Ini hanya tambahan kecil ke bagian terakhir. Jika Anda tahu apa yang telah teroksidasi dan apa yang telah dikurangi, maka Anda dapat dengan mudah mengetahui apa itu agen pengoksidasi dan reduktor. Contoh 1 Ini adalah reaksi antara ion kromium (III) dan logam seng: Kromium telah beralih dari +3 ke keadaan oksidasi +2, dan karenanya telah berkurang. Seng telah berubah dari nol oksidasi dalam elemen menjadi +2. Telah teroksidasi. Jadi apa yang dilakukan pengurangan? Ini adalah seng - seng memberikan elektron ke ion krom (III). Jadi seng adalah agen pereduksi. Demikian pula, Anda dapat mengetahui bahwa zat pengoksidasi haruslah ion kromium (III), karena mereka mengambil elektron dari seng. Contoh 2 Ini adalah persamaan untuk reaksi antara ion manganat (VII) dan ion besi (II) dalam kondisi asam. Ini bekerja lebih jauh di bawah halaman. Melihatnya dengan cepat, jelas bahwa ion besi (II) telah teroksidasi menjadi ion besi (III). Mereka masing-masing kehilangan satu elektron, dan tingkat oksidasi mereka meningkat dari +2 menjadi +3. Hidrogen masih dalam keadaan oksidasi +1 sebelum dan sesudah reaksi, tetapi ion manganat (VII) telah berubah dengan jelas. Jika Anda menghitung tingkat oksidasi mangan, ia telah turun dari +7 menjadi +2 - pengurangan. Jadi ion besi (II) telah teroksidasi, dan ion manganat (VII) berkurang. Apa yang telah mengurangi ion manganat (VII) - jelas itu adalah ion besi (II). Besi adalah satu-satunya hal lain yang memiliki perubahan tingkat oksidasi. Jadi ion besi (II) adalah agen pereduksi. Demikian pula, ion manganat (VII) harus menjadi zat pengoksidasi. Menggunakan keadaan oksidasi untuk menentukan proporsi reaksi Ini kadang-kadang berguna di mana Anda harus bekerja di luar proporsi reaksi untuk digunakan dalam reaksi titrasi di mana Anda tidak memiliki informasi yang cukup untuk menyelesaikan persamaan ion lengkap. Ingat bahwa setiap kali keadaan oksidasi berubah oleh satu unit, satu elektron telah ditransfer. Jika keadaan oksidasi satu zat dalam reaksi turun 2, itu berarti ia telah memperoleh 2 elektron. Sesuatu yang lain dalam reaksi pasti kehilangan elektron-elektron itu. Setiap keadaan oksidasi yang jatuh oleh satu zat harus disertai dengan peningkatan oksidasi yang sama dengan sesuatu yang lain. Contoh ini didasarkan pada informasi dalam pertanyaan tingkat AQA A yang lama. Ion yang mengandung serium dalam keadaan oksidasi +4 adalah zat pengoksidasi. (Mereka lebih rumit daripada hanya Ce 4+ .) Mereka dapat mengoksidasi ion yang mengandung molibdenum dari +2 ke keadaan oksidasi +6 (dari Mo2 + ke MoO 42- ). Dalam prosesnya cerium direduksi menjadi oksidasi +3 (Ce 3+ ). Berapa proporsi reaksi? Keadaan oksidasi molibdenum meningkat sebesar 4. Itu berarti bahwa keadaan oksidasi cerium harus turun sebesar 4 untuk mengkompensasi. Tetapi tingkat oksidasi cerium di masing-masing ion hanya turun dari +4 menjadi +3 - turun dari 1. Jadi, harus jelas ada 4 ion cerium yang terlibat untuk setiap ion molibdenum. Proporsi yang bereaksi adalah 4 ion yang mengandung serium hingga 1 molibdenum. Atau untuk mengambil contoh yang lebih umum melibatkan ion besi (II) dan ion manganat (VII). . . Suatu larutan kalium manganat (VII), KMnO 4, diasamkan dengan asam sulfat encer mengoksidasi besi (II) ion besi (III) ion. Dalam prosesnya, ion manganat (VII) direduksi menjadi ion mangan (II). Gunakan bilangan oksidasi untuk menghitung persamaan reaksi. Keadaan oksidasi mangan dalam ion manganat (VII) adalah +7. Namanya memberitahu Anda itu, tapi kerjakan lagi hanya untuk latihan! Dalam menuju ion mangan (II), keadaan oksidasi mangan telah turun sebesar 5. Setiap ion besi (II) yang bereaksi, meningkatkan keadaan oksidasinya dengan 1. Itu berarti bahwa harus ada lima ion besi (II) yang bereaksi untuk setiap satu ion manganat (VII). Oleh karena itu, sisi kiri persamaan adalah: MnO 4 - + 5Fe 2+ +? Sisi kanan adalah: Mn 2+ + 5Fe 3+ +? Setelah itu Anda harus menebak bagaimana cara menyeimbangkan atom yang tersisa dan muatannya. Dalam hal ini, misalnya, sangat mungkin bahwa oksigen akan berakhir di air. Itu berarti bahwa Anda memerlukan hidrogen dari suatu tempat. Itu bukan masalah karena Anda memiliki reaksi dalam larutan asam, sehingga hidrogen bisa berasal dari ion hidrogen. Akhirnya, Anda akan berakhir dengan ini: Secara pribadi, saya lebih suka mengerjakan persamaan ini dari persamaan setengah elektron!
| ||||||||||||||||||||||
Sunday, June 2, 2019
GAMPANG!!! MATERI BILOKS | BILANGAN OKSIDASI (ANGKA OKSIDASI)
Subscribe to:
Post Comments (Atom)
No comments:
Write komentar