DEFINISI OKSIDASI DAN REDUKSI (REDOKS) Halaman ini membahas berbagai definisi oksidasi dan reduksi (redoks) dalam hal transfer oksigen, hidrogen, dan elektron. | ||
Oksidasi dan reduksi dalam hal transfer oksigenDefinisi
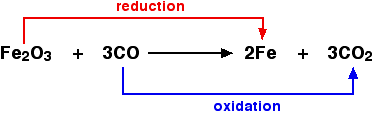
Misalnya, dalam ekstraksi besi dari bijihnya:
Agen pengoksidasi dan pereduksi Zat pengoksidasi adalah zat yang mengoksidasi sesuatu yang lain. Dalam contoh di atas, besi (III) oksida adalah zat pengoksidasi. Agen pereduksi mengurangi sesuatu yang lain. Dalam persamaan tersebut, karbon monoksida adalah zat pereduksi.
Definisi
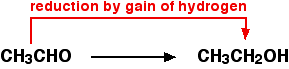
Misalnya, etanol dapat dioksidasi menjadi etanol:
| ||
Etanal juga dapat direduksi kembali menjadi etanol dengan menambahkan hidrogen ke dalamnya. Zat pereduksi yang mungkin adalah natrium tetrahidridoborat, NaBH 4 . Sekali lagi persamaannya terlalu rumit untuk diperhatikan pada saat ini.
Definisi
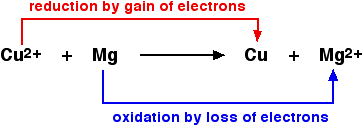
Persamaan menunjukkan reaksi redoks sederhana yang jelas dapat dijelaskan dalam hal transfer oksigen. Tembaga (II) oksida dan magnesium oksida keduanya ionik. Logamnya jelas bukan. Jika Anda menulis ulang ini sebagai persamaan ion, ternyata ion oksida adalah ion penonton dan Anda dibiarkan dengan:
Jika Anda melihat persamaan di atas, magnesium mengurangi ion tembaga (II) dengan memberi mereka elektron untuk menetralkan muatan. Magnesium adalah agen pereduksi. Melihat sebaliknya, ion tembaga (II) mengeluarkan elektron dari magnesium untuk membuat ion magnesium. Ion tembaga (II) bertindak sebagai zat pengoksidasi. Peringatan! Ini berpotensi sangat membingungkan jika Anda mencoba mempelajari apa arti oksidasi dan reduksi dalam hal transfer elektron, dan juga mempelajari definisi oksidator dan reduktor dalam istilah yang sama. Secara pribadi, saya akan merekomendasikan Anda menyelesaikannya jika Anda membutuhkannya. Argumen (terjadi di dalam kepala Anda) akan seperti ini jika Anda ingin tahu, misalnya, apa yang dilakukan agen pengoksidasi dalam hal elektron:
© Thank For Jim Clark 2002 | ||
Sunday, June 2, 2019
MUDAH DIPAHAMI!!! | PENGERTIAN OKSIDASI DAN REDUKSI (REDOKS)
Subscribe to:
Post Comments (Atom)

No comments:
Write komentar